Dans cette activité, les étudiants décriront les effets d’un acide sur une coquille. La réaction de la coquille d’œuf dans le vinaigre est une réaction acido-basique. La coquille d’un œuf, immergé dans le vinaigre, dissoudra et laissera intacte la membrane semi-perméable intérieure.
Le vinaigre (un acide) fait séparer les cristaux de carbonate de calcium solide (une base) trouvés dans la coquille à leurs parties individuelles de calcium et de carbonate. Les ions de calcium restent dissous dans le vinaigre (les ions de calcium sont des atomes qui manquent des électrons), tandis que le carbonate continue de faire le dioxyde de carbone — les petites bulles visibles sur la coquille.
Le vinaigre acide laisse intacte la membrane : c’est-à-dire la partie de l’œuf qui recouvre l’intérieur de la coquille. Un peu de vinaigre imprègne la membrane et cela explique le gonflement de l’œuf (la prochaine activité fournira une bonne explication de l’osmose). Si un œuf est secoué, le jaune, qui patauge dans le blanc, sera visible. Si la membrane est déchirée, le contenu se renverser exactement comme un œuf cru, mais cette fois, ce qui est dans l’œuf est désormais « conservés » dans le vinaigre.
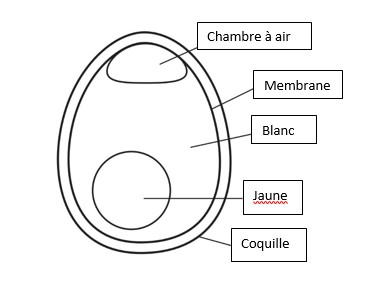
Astuce : Les élèves plus jeunes pourraient penser que la coquille extérieure a « transformé » dans la membrane. Rappelez-leur que la coquille extérieure et la membrane intérieure sont deux couches complètement différentes. Vous pouvez casser un œuf cru pour les montrer à la classe.