Dans cette démonstration, en observant le pouvoir de la tension superficielle dans les gouttes d’eau, les assomptions d’étudiants seront mises au défi. Malgré la charge positive d’une molécule d’eau, la structure réelle de cette molécule fait que c’est polaire (c’est-à-dire qu’il y a un côté positif et négatif). Les deux atomes d’hydrogène ont une charge partielle positive et l’atome d’oxygène a une charge partielle négative. En raison de cette propriété, les molécules d’eau s’attirent les uns les autres, entre l’atome d’oxygène chargé négativement d’une molécule et les atomes chargés positivement d’une autre molécule voisine. Ce lien faible s’appelle une liaison d’hydrogène. La polarité d’une molécule d’eau fait qu’elle s’attire aux autres molécules composées des substances aussi polaires.
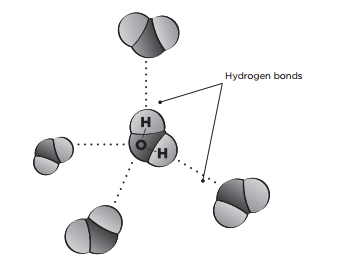
Il y a deux forces « collantes » dans cette démonstration: la cohésion and l’adhésion. L’attirance entre les molécules d’eau s’appelle la cohésion. La force cohésive entre les molécules d’eau est si forte qu’à la couche supérieure d’eau, il y a une espèce de « peau » appelée la tension superficielle. La tension superficielle est assez forte pour soutenir des insectes qui traversent la surface d’eau, comme les araignées d’eau.
Les forces cohésives sont fortes mais pas incassables. À mesure que la goutte grandit et se gonfle au-dessus des côtés de la pièce, la force de gravité sur les molécules devient plus forte que la force cohésive. La « peau » finira par éclater et toute l’eau s’écoulera.
La force d’attraction entre les molécules de natures différentes (comme le sol et le verre) s’appelle l’adhésion. En ajoutant plus de gouttes d’eau à la pièce, la force adhésive entre l’eau et la pièce empêche l’eau de s’écouler.
Les forces cohésives entre les molécules polaires sont plus fortes que celles entre les molécules non-polaires, comme dans l’huile ou le sirop. C’est pourquoi le « tas » d’eau est plus grand qu’un « tas » d’huile ou de sirop.
